
文章来源:医药云端工作室:挖掘趋势中的价值 作者:瑜伽猫
9月4日,CFDA举行新闻发布会,正式发布新修订的《医疗器械分类目录》,分为22个子目录,自2018年8月1日起实施。希望通过本文的分析,能够帮助大家更清楚地梳理新版与旧版之间的变化。
第一, 分类范围和分类方法
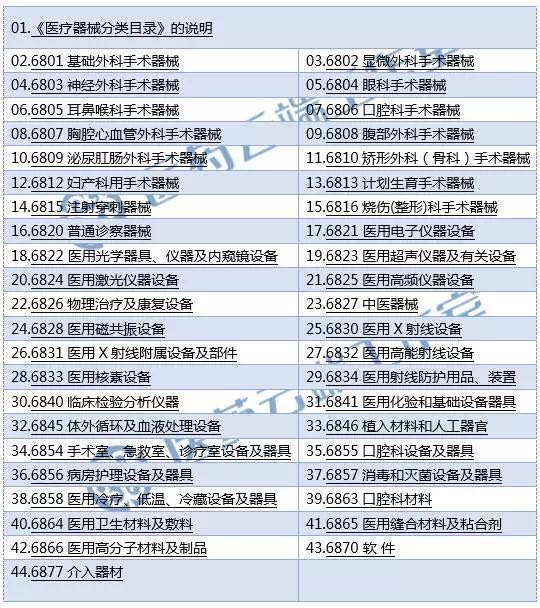
新版的分类目录对子目录进行了较大程度的合并,而在合并的同时,对于原先子目录下的产品名称举例,则进行了大量的增加,用数据来说,新《分类目录》将2002版目录的43个子目录整合精简为22个子目录;
将260个产品类别细化扩充为206个一级产品类别和1157个二级产品类别;增加了产品预期用途和产品描述;
在原1008个产品名称举例的基础上,扩充到6609个典型产品名称举例。这样做,就很大程度上方面了基层操作,减少了解释工作的时间。
举例来说,原来的分类中,普通的手术剪刀,显微手术的剪刀,耳鼻喉科的手术剪刀和腹部手术,泌尿外科手术的手术剪刀分别属于五个子目录管辖,而实际上大部分生产手术剪刀的厂商可以同时生产这五种剪刀,这五种剪刀医学上的风险也相似,所以在新版目录中,就把这五类都归到了同一个子目录中,减少了一些不必要的麻烦。
而在原来目录中,对于内窥镜的分类和举例有所不足,只简单分成手术用内窥镜,光学内窥镜和电子内窥镜。但是这十多年内窥镜的发展飞速,旧的分类标准明显不够用,因此新的分类标准增加了胶囊内窥镜一个二级子类,同时对于光学内窥镜区细化为经过创口进入身体的和经过自然腔道进入身体的,分别给予三类和二类风险管理类别。
另外在品名举例一栏增加了非常多的举例,仅在经自然腔道进入身体的光学内窥镜一栏,就有膀胱镜、鼻内窥镜、鼻窦镜、儿童喉镜系统、耳内窥镜、喉镜、口腔内窥镜、口腔与口腔颌面外科内窥镜、尿道膀胱镜、气管镜管、硬性纤维乳管内窥镜、食道镜、小儿支气管内窥镜、咽喉镜、乙状结肠内窥镜、硬性纤维输尿管肾镜、直肠内窥镜、纤维结肠镜、纤维鼻咽喉镜、纤维胆管内窥镜、纤维儿童喉镜、纤维尿道膀胱镜、纤维食道镜、纤维胆道内窥镜、纤维上消化道镜、纤维输尿管肾镜、尿道内切开内窥镜这么多的举例,明显跟上了技术发展的变化。
旧版分类目录的子类:
新版分类目录的子类
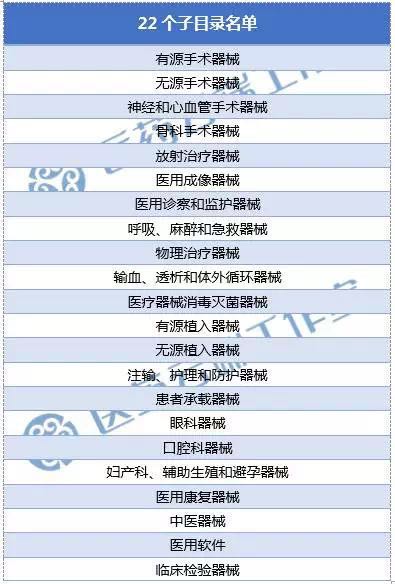
如果对照CE的分类和FDA的分类来看,药监局新的分类在有源,无源这些分类上部分参考了CE的分类思路,而在眼科,口腔科,妇产科,神经与心血管手术这些分类上参考了FDA的分类思路,实际上这两种分类思路同时使用会有一些重合地带,新的分类做出了一定的妥协。
比如有源无源和骨科,普外科是完全不同的分类思路,因此在新版分类目录中大部分有源手术器械归属于一个大类,但是骨科用的动力设备被单独拎出来,归到了骨科手术器械这个大类中,而骨科常用的另一种有源手术器械超声骨刀又放在了有源器械里,比较奇怪。
所以企业的产品具体属于哪个大类,还是需要注册部门仔细阅读新版分类目录,有模糊的地方或者新版分类目录页没有明确说明的,还是需要进行分类界定。不过总体里说,新版比旧版还是进步了不少。
另外需要注意的是,新的分类目录还没有包括体外诊断试剂,有关体外诊断试剂的情况主要有三个文件在管理,包括《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第5号,以下简称5号令)、《体外诊断试剂注册管理办法修正案》(总局令第30号,以下简称30号令)、《6840 体外诊断试剂分类子目录(2013版)》,对于体外诊断试剂,还需要密切关注后续发布的分类界定文件中有关体外诊断试剂的分类界定意见。
新的分类目录覆盖了部分药械组合产品,如药物球囊,载药支架,含药骨水泥等等,但是对于新的分类目录中未覆盖的新产品,需要引起足够重视,具体申请时还是需要联系药监局进行分类界定,因为是否含药可能会影响分类。
如含药的胃镜润滑剂属于三类,不含药的属于二类,这与通常分类界定的标准是否侵入人体等并不统一,还需要药监局的解释。
第二, 某些产品前后分类界定发生了变化
在对比前后的分类目录后发现,有些产品从三类降为了二类,有些从二类降为了一类。还有些产品是升了类别,还有些产品将不再作为医疗器械管理。产品类别上的变化是要直接影响医疗器械生产经营企业的,比如生产企业,原本自家产品是三类,降为二类管理之后,企业将无需再跑到北京、到药监总局来进行产品注册,只需在本省药监局注册即可。
当然,反过来,对升类产品而言,注册要比现在麻烦一些了,由二类升为三类的,风险级别大增,也将面临药监更为严格和密集的监管举措。
降类产品主要包括:

升类产品主要包括:

不再作为医疗器械管理
包括:试镜架、注射器用活塞、输液瓶贴、输注工作站、含消毒剂(抗菌剂)阴道填塞产品、放射治疗患者床板、医疗信息管理软件(仅仅是医院管理工具,管理内容是患者信息等非医疗诊断和/或治疗内容)、不包含医学图像或者数据的远程医疗会诊系统软件、与临床检验有关,但产品自身不具有医疗器械功能的产品等,不再按照医疗器械管理。
第三, 关于过渡期的注册,延续注册和经营许可证问题
总体上来说,药监局的指导精神还是以2018年8月1日为界,老人老办法,新人新办法,关于具体是按照旧的分类目录还是新的分类目录发证,按照时间点主要分为三种情况。
包括1:生效日前已经递交申请并作出审批决定的;2:生效日前已经递交申请但尚未作出审批决定的;3:完全在生效日之后提交申请的。
对于情况1和情况3来说,不存在什么争议,所以情况1就是发完全的老证,情况3就是未来审批通过的话发完全的新证。只有情况2存在较多不同可能。
对于情况2来说,可进一步细分为两种情况,就是新旧分类目录的分类是否发生了变化。如果没有发生分类变化,那么就按照新的分类目录发证,注册证上备注原注册证编号。
如果发生了分类调整,那么还是按照原分类目录发证,注册证上备注新分类目录管理类别和分类编码。
关于延续注册的情况3,还有一点点小问题,因为延续注册现在规定一般是要旧证到期6个月之前提出延续注册申请,实际上新的分类目录下来后部分产品的分类界定发生了变化,特别是最倒霉的是从二类变为三类的产品,提前六个月申请可能远远不够,因此总局又做了部分补充。
主要分为降类的和升类的两种情况。对于降类的,自然皆大欢喜,按计划在到期六个月前提出延续注册申请,通过后该发二类发二类,一类该办理备案的办理备案。
而对于升类的,特别是二类升三类的,理论上公司应该自己计算好三类申请的各种时间消耗,尽快向药监局申请三类注册。
但是确实有一部分二类转三类的延续注册,有效期距离2017年8月1日不足一年了(2019年8月31前到期),对于这类企业,药监局网开一面,允许企业向原审批部门提请延期。
对于医疗器械的生产和经营企业来说,由于器械分类号发生了很大变化,医疗器械注册号也会逐步跟着变化。因此新旧的生产许可证和经营许可证也会同时发生变化。
2018年8月1日起新发的生产和经营许可证都会把产品登记表分为旧版编码区和新版编码区,采用逐步过渡的方法把生产许可证和经营许可证覆盖的产品逐步从旧版编码区移到新版编码区。
对于生产许可证和经营许可证,监管部门还没有太多关于前后变化带来的具体指导意见,但是从原理上来说,特别是某些产品的分类会从二类调整为三类,而二类器械生产企业/经营企业和三类生产企业/经营企业需要的资质还略有不同,因此相关收到波及的企业还是要尽早与药监局沟通,尽快转换生产/经营资质,以期将相关影响降到最低。